Abordaje integral del paciente con DM2
ISBN: 978-84-09-32813-0
PDF: Descargar
Complicaciones de la DM
3.1. Complicaciones agudas de la diabetes

3.1.1. Hipoglucemia
Se considera hipoglucemia cualquier episodio de concentración plasmática de glucosa anormalmente baja (con o sin síntomas) en el que el individuo se expone a un daño1.
La American Diabetes Association (ADA) la define como el descenso de la glucemia por debajo de 70 mg/dl2, independientemente de la severidad de los síntomas.
Es la complicación aguda más limitante de las personas con diabetes. Su frecuencia y gravedad se relaciona directamente con el tratamiento con sulfonilureas e insulina, así como la falta de ingesta de alimentos, exceso de ejercicio físico y/o ingesta de alcohol.
La hipoglucemia se clasifica en:
 Nivel 1: niveles de glucosa en sangre < 70 mg/dl y ≥ 54 mg/dl.
Nivel 1: niveles de glucosa en sangre < 70 mg/dl y ≥ 54 mg/dl.
 Nivel 2: niveles de glucosa < 54 mg/dl.
Nivel 2: niveles de glucosa < 54 mg/dl.
 Nivel 3: cuadro severo caracterizado por alteraciones cognitivas y/o físicas que requieren de la asistencia de terceras personas para su resolución independientemente del valor de la glucemia.
Nivel 3: cuadro severo caracterizado por alteraciones cognitivas y/o físicas que requieren de la asistencia de terceras personas para su resolución independientemente del valor de la glucemia.
 Otros tipos:
Otros tipos:

Síntomas
La sintomatología de la hipoglucemia es diversa, por lo que sus síntomas se agrupan en dos grandes grupos, siendo los adrenérgicos los primeros en producirse y, si esta hipoglucemia no es resuelta correctamente, apareciendo a continuación la sintomatología neuroglucopénica:
 Adrenérgicos (causados por las hormonas adrenérgicas tratando de elevar la glucemia): palidez, sudor frío, irritabilidad, temblor, taquicardia, ansiedad, palpitaciones.
Adrenérgicos (causados por las hormonas adrenérgicas tratando de elevar la glucemia): palidez, sudor frío, irritabilidad, temblor, taquicardia, ansiedad, palpitaciones.
 Neuroglucopénicos (causados por el déficit de glucosa en el cerebro): confusión, mareo, debilidad, dolor de cabeza, falta de concentración y coordinación, marcha inestable, convulsiones y coma.
Neuroglucopénicos (causados por el déficit de glucosa en el cerebro): confusión, mareo, debilidad, dolor de cabeza, falta de concentración y coordinación, marcha inestable, convulsiones y coma.
Causas de la hipoglucemia
 Cambios y/o errores en la alimentación, insuficiente aporte de hidratos de carbono, alteraciones de horarios de comidas.
Cambios y/o errores en la alimentación, insuficiente aporte de hidratos de carbono, alteraciones de horarios de comidas.
 Errores con la medicación o en su administración: olvido, retraso, dosis errónea, falta de destreza en la valoración R/R, ingesta errónea de sulfonilureas.
Errores con la medicación o en su administración: olvido, retraso, dosis errónea, falta de destreza en la valoración R/R, ingesta errónea de sulfonilureas.
 Ejercicio no planificado o prolongado.
Ejercicio no planificado o prolongado.
 Alcohol, drogas, interacciones medicamentosas.
Alcohol, drogas, interacciones medicamentosas.
 HbA1c < 6,5 % o > 9 % y, especialmente, en < 6 %. IMC bajo (< 18,5 %).
HbA1c < 6,5 % o > 9 % y, especialmente, en < 6 %. IMC bajo (< 18,5 %).
 Uso concomitante de fármacos beta-bloqueantes, neurolépticos, IECA, AINE, ansiolíticos3…
Uso concomitante de fármacos beta-bloqueantes, neurolépticos, IECA, AINE, ansiolíticos3…
Prevención de las hipoglucemias4-5
La educación terapéutica en diabetes (ETD) es fundamental para la prevención de las hipoglucemias, mediante un proceso educativo integral que siga los distintos capítulos de nuestra guía (TN, ejercicio físico…). Cuando se objetiven hipoglucemias desapercibidas o de nivel 2-3 sin explicación, deberemos elevar los objetivos glucémicos para evitar hipoglucemia durante algunas semanas con el fin de revertir parcialmente la hipoglucemia inconsciente y reducir el riesgo de episodios futuros.

Tratamiento
 Paciente consciente: se recomienda utilizar la regla del 15.
Paciente consciente: se recomienda utilizar la regla del 15.
No utilizar alimentos ricos en grasa o proteínas que enlentecen la resolución del episodio4.

|
Persona consciente Regla del 15 |
Administrar 15 g de HC de absorción rápida2 y glucemia capilar a los 15 minutos |
Glucemia > ٧٠ Administrar ١ ración de HC absorción lenta para evitar nueva hipoglucemia. |
|
Glucemia < 70 Repetir toma de HC de absorción rápida y nueva determinación tras 15 minutos. |
||
|
Persona inconsciente |
Administrar glucagón (inyectable o intranasal) |
Tras recuperar la consciencia, administrar una ración de HC de absorción lenta para evitar una nueva hipoglucemia. |
Una vez revertida la hipoglucemia, se deben ingerir 1 o 2 raciones de hidratos de carbono de absorción lenta para evitar una hipoglucemia recurrente.

 Paciente inconsciente o con incapacidad de consumir alimentos por la boca.
Paciente inconsciente o con incapacidad de consumir alimentos por la boca.
El tratamiento de elección en este tipo de paciente será el glucagón inyectable o intranasal. Familiares, cuidadores, compañeros de escuela, piso o trabajo deberían estar familiarizados con los kits de glucagón, así como cuándo y cómo administrarlo. No precisa ser administrado por un profesional sanitario. Se debe vigilar la fecha de caducidad con periodicidad4.
Si esto no fuera posible, se puede utilizar la vía intravenosa de glucosa (15-25 g) IV durante 1-3 min. No administrar nada por la boca por el peligro de aspiración.
3.1.2. Hiperglucemia
Se considera hiperglucemia un episodio con valores glucémicos por encima de los valores máximos objetivos, causados por una falta absoluta o relativa de insulina6, que puede acompañarse de otras alteraciones metabólicas (cetonuria, cetonemia, alteraciones del pH…). Se clasifica en:
 Hiperglucemia simple: glucemia 200 mg/dl sin otras alteraciones metabólicas.
Hiperglucemia simple: glucemia 200 mg/dl sin otras alteraciones metabólicas.
 Cetosis diabética: hiperglucemia sintomética (poliuria, polidipsia, polofagia, cansancio...) con presencia de cuerpos cetónicos en sangre.
Cetosis diabética: hiperglucemia sintomética (poliuria, polidipsia, polofagia, cansancio...) con presencia de cuerpos cetónicos en sangre.
 Cetoacidosis diabética (CAD): hiperglucemia > 300 mg/dl, cetonemia positiva y acidosis metabólica (pH < 7,25).
Cetoacidosis diabética (CAD): hiperglucemia > 300 mg/dl, cetonemia positiva y acidosis metabólica (pH < 7,25).
 Coma hiperosmolar no cetósica (DHNNC): hiperglucemia importante, osmolaridad elevada, deshidratación grave, sin cetosis.
Coma hiperosmolar no cetósica (DHNNC): hiperglucemia importante, osmolaridad elevada, deshidratación grave, sin cetosis.
La hiperglucemia puede ser causada por medicación hiperglucemiante (corticoides), no adherencia al tratamiento prescrito, trasgresiones dietéticas sobre la alimentación prescrita, abandono del ejercicio habitual o ejercicio intenso, situaciones de estrés (traumatismos, infecciones, cirugía, etc.), mala técnica en la administración de la insulina, lipohipodistrofias….
Síntomas
La hiperglucemia se manifiesta con poliuria, polidipsia y polifagia.
En la cetosis a los síntomas de hiperglucemia se suman los derivados de la existencia de cuerpos cetónicos (anorexia, molestias estomacales, náuseas, cansancio, aliento “cetósico”). Sería necesario realizar cetonuria o cetonemia si se presenta glucemia ≥ 250-300 mg/dl acompañada de síntomas y/o procesos infecciosos.
La cetoacidosis engloba los síntomas de la hiperglucemia, de la gran enorme presencia de cetonas más deshidratación (alteración de la respiración, taquicardia y alteración de la conciencia, pudiendo llegar al coma y la muerte).
La cetosis y la cetoacidosis tienen como causa un déficit importante de insulina. Son más frecuentes en la diabetes tipo ١. La hiperglucemia no corregida puede derivar en cetosis o cetoacidosis por acúmulo de cuerpos cetónicos en sangre.7

|
HA |
CA |
SHHNC |
|
|
Presentación clínica |
Asintomático. Clínica cardinal. |
DM1 • Dificultad respiratoria. • Dolor abdominal. • Vómitos, fetor. |
DM2 • Ancianos. • Deshidratación. • Bajo nivel de |
|
Glucemia |
> 200 |
250-600 |
> 600 |
|
C. cetónicos |
–/+++ |
+++ |
–/+ |
Tratamiento
Ante una situación hiperglucémica mantenida se debe valorar la existencia o no de cetonas en sangre y/u orina. Su detección y tratamiento puede evitar la evolución del cuadro hacia la cetoacidosis diabética. Se recomienda aumentar los controles de glucemia y no realizar ejercicio físico en esta situación.7

|
Cetosis |
Cetonemia (mmol/l) |
Cetonuria |
|
Negativa |
≤ 0,5 |
– |
|
Indicios |
0,6-0,9 |
+ |
|
Leve |
1-1,4 |
++ |
|
Moderada |
1,5-2,9 |
+++ |
|
Grave |
> 3 |
++++ |
La hidratación del paciente debe estar garantizada ya sea por vía oral en la hiperglucemia simple y la cetosis o por vía IV en el caso de cetoacidosis o descompensación hiperosmolar.
Se debe mantener el plan de alimentación siempre que sea posible garantizando un mínimo de 100-150 mg de hidratos de carbono y nunca interrumpir la administración de la medicación oral. El tratamiento con insulina también debe complementarse con suplementos correctores de insulina rápida que se mantendrán mientras haya fiebre, cetonuria/cetonemia positiva y/o glucemias altas.


*ISCI: pacientes con infusor subcutáneo de insulina (bomba).
Al disminuir la glucemia, iniciaremos la ingesta de alimentos azucarados en el mismo horario de las ingestas habituales (esto conseguirá disminuir la liposis). Algunos ejemplos serían: zumos de fruta natural (100-200 ml de zumo); una hora después, 200 ml de leche y dos galletas; una hora más tarde, crema de verduras ligeras; con lo que combinaríamos zumos de frutas, leche y/o yogures desnatados con galletas y purés de verduras sin grasa, todo esto enfocado a aportar pocas proteínas y nada de grasas.

3.1.3. Enfermedades intercurrentes
La aparición de enfermedades intercurrentes puede dar lugar a descompensaciones hiperglucémicas agudas (glucemias ≥ 250-300 mg/dl) y precipitar una descompensación cetoacidótica o una situación hiperglucémica hiperosmolar.
La actitud a seguir dependerá de la magnitud de la hiperglucemia, el tratamiento habitual del paciente, la presencia o no de cetonemia y su intensidad, pero en cualquiera de los casos será necesaria la monitorización de la glucemia capilar de forma intensiva y, en algunos casos, el control de cuerpos cetónicos.
El factor precipitante más frecuente para la aparición de hiperglucemia es la infección. Los estadios infecciosos febriles provocan un estrés físico al organismo que se traduce en un aumento del catabolismo y de la producción de hormonas contrarreguladoras (principalmente cortisol y glucagón) que favorecen la aparición de hiperglucemia pudiendo desencadenar una cetosis. El estado hiperglucémico mantenido es un excelente medio de cultivo para los microrganismos contribuyendo a alargar el proceso de curación.


Otras enfermedades intercurrentes, como el infarto agudo de miocardio, la insuficiencia cardíaca, renal o hepática, traumatismos graves o cirugías mayores pueden ocasionar estadios hiperglucémicos que requieran una insulinización transitoria para controlar los niveles de glucemia.
En los casos en los que se requiera tratamiento con glucocorticoides, la insulina es el fármaco de elección para el control de la hiperglucemia inducida por estos. La elección del tipo de insulina y su dosificación se hará en función del tipo de glucocorticoide (acción intermedia o larga duración) y si el paciente tenía o no, previamente, tratamiento con insulina.


La cetosis se tratará a nivel de Atención Primaria con insulina rápida s.c. que se administrará en ingestas + hidratación vía oral. Cuando la glucemia inicie su descenso, añadiremos alimentos azucarados en horarios de ingestas (para disminuir la lipolisis):
 Zumos de fruta natural.
Zumos de fruta natural.
 Leche y/o yogures desnatados.
Leche y/o yogures desnatados.
 Galletas y purés de verduras sin grasas.
Galletas y purés de verduras sin grasas.
 Ejemplo: 100-200 ml de zumo; 1 hora después, 200 ml de leche y dos galletas; 1 hora después, crema de verduras ligera.
Ejemplo: 100-200 ml de zumo; 1 hora después, 200 ml de leche y dos galletas; 1 hora después, crema de verduras ligera.
 No aportaremos grasas ni demasiadas proteínas.
No aportaremos grasas ni demasiadas proteínas.
En la cetosis diabética también se debe administrar insulina. El procedimiento será:
 Pacientes tratados con insulina: dar suplementos de insulina rápida del 20 % de su dosis total habitual repartido en las cuatro ingestas que recomendemos (+/– cada 4-6 horas).
Pacientes tratados con insulina: dar suplementos de insulina rápida del 20 % de su dosis total habitual repartido en las cuatro ingestas que recomendemos (+/– cada 4-6 horas).
 Pacientes no tratados con insulina: insulinizar con 0,3-0,4 UI/kg/día y repartirlo en las cuatro ingestas que recomendemos. Si metformina, retirarla durante la descompensación cetósica.
Pacientes no tratados con insulina: insulinizar con 0,3-0,4 UI/kg/día y repartirlo en las cuatro ingestas que recomendemos. Si metformina, retirarla durante la descompensación cetósica.
Bibliografía
3.2. Complicaciones crónicas
El desarrollo de complicaciones macrovasculares asociadas a la DM (enfermedad cardiovascular arteriosclerótica), es la principal causa de morbimortalidad en los pacientes con DM1. Para prevenir su aparición tiene especial importancia el adecuado control de los factores de riesgo clásicos (Tabla 3), así como el cumplimiento de estilos de vida saludables (Figura 4): alimentación, ejercicio físico y abandono del hábito tabáquico.

|
Tensión |
Pacientes en general. |
TA < 140/80 mmHg |
|
Pacientes de alto RCV1, riesgo de ACVA, jóvenes, presencia de albuminuria. |
TA < 130/80 mmHg2 |
|
|
Pacientes con larga expectativa de vida, ERC, albuminuria o presencia de otros FRCV. |
TAD < 80 mmHg |
|
|
Dislipemia3 |
RCV muy alto: DM de duración > 20 años, presencia de lesión en órgano diana y ≥ 3 FRCV. |
LDL-c < 55 mg/dl Reducción relativa de LDL ≥ 50 % |
|
RCV alto: DM de duración > 10 años sin lesiones en órgano diana y 1 FRCV. |
LDL-c < 70 mg/dl Reducción relativa de LDL ≥ 50 % |
|
|
RCV moderado: pacientes jóvenes (DM tipo 1 < 35 años, DM 2 < 50 años y duración < 10 años). |
LDL-c < 100 mg/dl |
1RCV: riesgo cardiovascular; 2Siempre que este objetivo se alcance sin riesgo para el paciente.


3.2.1. Complicaciones macrovasculares
Cardiopatía isquémica
La cardiopatía isquémica es una complicación macrovascular asociada a la DM con la enfermedad coronaria como principal origen. Sus distintas manifestaciones (angina, infarto, disnea) pueden presentarse con una clínica atenuada en el paciente con DM. El cribado de CI no mejora la morbimortalidad cardiovascular; sin embargo, existe una alta prevalencia de cardiopatía isquémica asintomática por lo que podría plantearse mediante prueba de imagen(ecocardiograma de estrés o SPECT, tomografía de emisión de foto única) en determinados pacientes (Tabla 4).
En la prevención de la CI en el paciente con DM es fundamental tanto conocer los antecedentes de riesgo cardiovascular (Tabla 5) como controlar los factores de riesgo modificables (Tabla 3). La estimación del RCV del paciente por las tablas REGICOR es necesaria para graduar la intensidad de las intervenciones (Tabla 6). GRADO D.



|
Recomendaciones |
Grado |
|
Se recomienda tratamiento antiagregante en prevención secundaria. |
A |
|
No se recomienda la antiagregación rutinaria en prevención primaria. |
A |
|
Se recomienda tratamiento con estatinas a los pacientes con DM en prevención secundaria. |
A |
|
Se recomienda tratamiento con estatinas a los pacientes con DM y RCV > 10 % REGICOR. |
B |
Enfermedad cerebrovascular
La enfermedad cerebrovascular (ECV) en el paciente con DM es relevante por las potenciales secuelas que puede originar. La DM es un factor de riesgo para padecer ECV, especialmente en mujeres, de ahí la importancia de su correcto control.
La ECV (ACVA5 o AIT) es una entidad aguda, por lo tanto, no susceptible de cribado. Se puede indagar sobre episodios previos que sugieran estadios previos a la ECV establecida (AIT), dada su importante incidencia de recidiva, y extremar el control de los factores de riesgo predisponentes.
La principal intervención en la prevención de la ECV se centra en la intervención multifactorial sobre los factores de riesgo cardiovascular, modificación de estilos de vida (Tabla 3 y Figura 4) y cumplimiento terapéutico, que ha de evaluarse al menos anualmente.
Cobra especial peso el control de la dislipemia y la albuminuria en este tipo de pacientes2:
 En todo paciente con ACVA o AIT (salvo contraindicación) debe pautarse tratamiento antiagregante. Grado A.
En todo paciente con ACVA o AIT (salvo contraindicación) debe pautarse tratamiento antiagregante. Grado A.
 El tratamiento con estatinas reduce la mortalidad por ictus en pacientes con DM tipo 2. Grado A.
El tratamiento con estatinas reduce la mortalidad por ictus en pacientes con DM tipo 2. Grado A.
 La albuminuria y el descenso del FG aumenta el riesgo de ECV. Recomendar tratamiento IECA en paciente con albuminuria > 300 mg/día. Grado A.
La albuminuria y el descenso del FG aumenta el riesgo de ECV. Recomendar tratamiento IECA en paciente con albuminuria > 300 mg/día. Grado A.
Enfermedad arterial periférica
La enfermedad arterial periférica (EAP) tiene como origen la placa de ateroma, que en el paciente con DM tiene un inicio más temprano y una evolución más agresiva.
En su diagnóstico (complejo al presentar fases asintomáticas hasta isquemia establecida con lesiones evidentes) podemos valorar:
 Anamnesis: clínica de claudicación intermitente, dolor de extremidades en reposo o en decúbito. Grado B.
Anamnesis: clínica de claudicación intermitente, dolor de extremidades en reposo o en decúbito. Grado B.
 Exploración: palpación de pulsos periféricos (intensidad, simetría) en diferentes territorios y realización del índice tobillo-brazo (ITB).
Exploración: palpación de pulsos periféricos (intensidad, simetría) en diferentes territorios y realización del índice tobillo-brazo (ITB).
El cribado de la EAP no es universal y se recomienda hacerlo en pacientes mayores de 50 años con sintomatología compatible o FRCV asociados (Grado B). En su prevención cobra especial valor el control de la tensión arterial, la dislipemia y el abandono del tabaco, además del control del resto de FRCV clásicos (Grado A). La recomendación de programas de ejercicio físico (hasta producir dolor, prolongando progresivamente la distancia) puede resultar beneficiosa (Grado C), aunque el ejercicio físico está contraindicado en situaciones de isquemia crítica (Estadio IV de Fontaine).
3.2.2. Complicaciones microvasculares
Nefropatía diabética
El diagnóstico de la ERC se establece mediante criterios analíticos que confirman la alteración de la función renal (Tabla 7). El cribado de esta complicación debe hacerse al menos una vez al año, mediante estimación de filtrado glomerular y cuantificación de albuminuria, desde el momento del diagnóstico en DM tipo 2 y a los cinco años del diagnóstico en DM tipo 1. El seguimiento de la ND (Tabla 8) dependerá del grado de afectación de la función renal.

|
Filtrado |
Descenso de eFG < 60 ml/min 1,73 m2 durante 3 meses. |
|
Albuminuria |
Cociente albúmina creatinina > 30 mg/g de creatinina en al menos dos de tres muestras durante más de 3 meses. |
|
Sedimento urinario |
Hematuria y/o leucocituria durante más de 3 meses descartadas causas urológicas e infecciosas. |
La importancia de definir el grado de afectación de la enfermedad renal crónica (ERC) permite hacer un seguimiento y establecer un pronóstico de la misma (clasificación pronóstica de ERC propuesta por KDIGO). Las recomendaciones a los pacientes (Tabla 9) refuerzan el conocimiento del cuidado de su enfermedad y contribuyen a mejorar la evolución de la afectación.

|
Anual |
eFG > 60 ml/min 1,73 m2 o albuminuria < 30 mg/g |
|
3-6 meses |
eFG < 60 ml/min 1,73 m2 y/o albuminuria > 30 mg/g |
|
Remitir a |
eFG < 30 ml/min y/o albuminuria > 300 mg/g Descenso de FG > 25 %, progresión de descenso > 5 ml/año |
El correcto control de la tensión arterial y la glucemia, el cese del hábito tabáquico y retrasar la aparición de microalbuminuria son factores determinantes para evitar la progresión de la ERC. Es importante detectar aquellos pacientes con ND que deben ser remitidos a consulta de nefrología: aquellos que muestran progresión de ERC (Tabla 9), alteraciones del potasio sin recibir diuréticos (> 5,5 mEq/l o < 3,5 mEq/l) o anemia a pesar de corregir ferropenia (Hb < 10,5 g/dl con índice de saturación de transferrina > 20 % y ferritina > 100).

|
Dieta |
Ingesta de proteínas aproximadamente en cantidad |
|
Control |
HbA1C < 7 %. Glucemia preprandial 80-130 mg/dl. Glucemia posprandial < 180 mg/dl. |
|
Tensión |
TA < 130/80 mmHg si nefropatía diabética o albuminuria |
|
Tratamiento farmacológico |
Evitar fármacos nefrotóxicos. Valorar tratamiento con IECA o ARA 2 y con fármacos iSGLT-2. Precaución pruebas con contraste radiológico. |
|
Autocuidados |
Control de TA, peso, edemas, cumplimiento terapéutico. Explicar manejo de fármacos en situaciones intercurrentes*. |
*Deshidratación, riesgo de depleción de volumen, estado de baja ingesta hídrica.
Neuropatía diabética
La neuropatía diabética es la complicación más prevalente asociada a la DM, pudiendo existir afectación del sistema nervioso antes del diagnóstico de la enfermedad. Se asocia tanto con los años de evolución de la enfermedad como con el grado de control metabólico. El estricto control glucémico junto con una intervención multifactorial son las medidas más importantes para frenar su progresión (Tabla 10).

|
Control |
Ralentiza la progresión de polineuropatía simétrica distal. Grado B. |
|
Intervención |
Intervención de control glucémico y factores de riesgo cardiovascular previene neuropatía autonómica cardiovascular. Grado C. |
|
Modificaciones de estilo de vida |
Mejoría en pacientes con prediabetes y síndrome metabólico. Grado B. |
La sintomatología, ausente en muchos casos, puede ser variable por lo que es necesario desde el momento del diagnóstico hacer un cribado y seguimiento anual de la presencia de neuropatía:
 Sintomatología sensitiva (parestesias, hipoestesias, calambres, pinchazos, quemazón, discriminación térmica, exploración con monofilamento y diapasón).
Sintomatología sensitiva (parestesias, hipoestesias, calambres, pinchazos, quemazón, discriminación térmica, exploración con monofilamento y diapasón).
 Motora (déficit motor, marcha inestable).
Motora (déficit motor, marcha inestable).
 Investigar posibles episodios de hipoglucemia inadvertida (mareos inexplicados, episodios de sudoración, ansiedad, hambre).
Investigar posibles episodios de hipoglucemia inadvertida (mareos inexplicados, episodios de sudoración, ansiedad, hambre).
 Valorar afectación de sistema autónomo cardiovascular (investigar ortostatismo, valorar alteraciones en ECG de la FC en inspiración y espiración).
Valorar afectación de sistema autónomo cardiovascular (investigar ortostatismo, valorar alteraciones en ECG de la FC en inspiración y espiración).
 Estudiar afectación digestiva (gastroparesia, diarrea), disfunción vesical (aumento de residuo miccional), disfunción sexual (masculina y femenina).
Estudiar afectación digestiva (gastroparesia, diarrea), disfunción vesical (aumento de residuo miccional), disfunción sexual (masculina y femenina).
 Investigar sobre la presencia de apneas nocturnas.
Investigar sobre la presencia de apneas nocturnas.
Retinopatía diabética
La retinopatía diabética (RD) es una complicación vascular asociada a la DM potencialmente grave por las alteraciones visuales permanentes que puede originar. El insuficiente control metabólico y el tiempo de evolución de la DM son factores asociados a su aparición y progresión.
Es necesario conocer el grado de afectación en los pacientes con RD por el riesgo de progresión en fases avanzadas (RD severa) hacia una retinopatía diabética proliferativa, momento en el que hay que evaluar si el paciente es candidato a alguna intervención oftalmológica para el control de esta afectación6.
El diagnóstico y cribado de la retinopatía en el paciente con DM se puede hacer en el ámbito de la Atención Primaria (utilización de cámara no midriática) o mediante la derivación a consulta de oftalmología. Se recomienda iniciar el cribado a los cinco años del diagnóstico en DM tipo 1 y, en caso de DM tipo 2, en el momento del diagnóstico, con una frecuencia variable en función del grado de afectación (Tabla 11).

|
Situación clínica |
Frecuencia de cribado. |
|
Momento diagnóstico |
Dentro del primer año del diagnóstico. Grado B. |
|
Sin lesiones de RD |
Buen control: cada 2-3 años. Grado C. Mal control: anualmente. Grado B. |
|
RD leve o moderada |
Cada 6-9 meses. Grado B. |
|
RD grave o |
Cada 4-6 meses. Grado B. |
|
Embarazo con |
Antes de la concepción, en cada trimestre y cada 6 meses durante el año siguiente al parto. Grado B. |
En el seguimiento del paciente con retinopatía diabética es importante considerar algunas medidas generales para el control de la progresión de las lesiones:
 Extremar el control glucémico (HbA1c < 7 %), evitando las hipoglucemias.
Extremar el control glucémico (HbA1c < 7 %), evitando las hipoglucemias.
 Realizar adecuado control tensional (TA < 140/80 mmHg).
Realizar adecuado control tensional (TA < 140/80 mmHg).
 Explorar la agudeza visual en consulta. Grado D.
Explorar la agudeza visual en consulta. Grado D.
 Incentivar el autocuidado del paciente: evitar ejercicios violentos, vigilar aparición de síntomas visuales.
Incentivar el autocuidado del paciente: evitar ejercicios violentos, vigilar aparición de síntomas visuales.
Bibliografía
3.3. Pie diabético
El Documento de Consenso Internacional de Pie Diabético del año 2019, editado por el Grupo Internacional de Trabajo del Pie Diabético (International Working Group of the Diabetic Foot,IWGDF) define el pie diabético como “la ulceración, infección o destrucción de tejidos profundos asociadas a neuropatía y/o enfermedad arterial periférica en las extremidades inferiores de las personas con diabetes”1. Previamente, en el año 1995, la Organización Mundial de la Salud (OMS) definió el pie diabético como “el síndrome resultante de la intervención de factores sistémicos (angiopatía, neuropatía e infección) y estilos de vida como el autocuidado, la higiene o el calzado, entre otros”2. Cabe destacar que las lesiones en el pie constituyen la primera causa de amputación no traumática en los países de renta alta. Alrededor del 1 % de las personas con diabetes sufre la amputación de algún miembro inferior con una frecuencia de 10 a 20 veces superior a la de las personas no diabéticas. Aproximadamente el 80 % de las amputaciones están precedidas por una úlcera en el pie.3 El pie diabético puede definirse como un síndrome, desde un punto de vista fisiopatológico, en el que coexisten la neuropatía, la isquemia y la infección. Destacan la presencia de:
 Factores predisponentes: neuropatía asociada en mayor o menor grado a una macro o microangiopatía, ambos son factores de riesgo para presentar lesión.
Factores predisponentes: neuropatía asociada en mayor o menor grado a una macro o microangiopatía, ambos son factores de riesgo para presentar lesión.
 Factores desencadenantes: traumatismos mecánicos, térmicos o químicos.
Factores desencadenantes: traumatismos mecánicos, térmicos o químicos.
 Factores agravantes: nos determinan el pronóstico de la enfermedad, como la infección, la isquemia o la neuropatía. Retrasan la cicatrización y conducen a la aparición de complicaciones.4
Factores agravantes: nos determinan el pronóstico de la enfermedad, como la infección, la isquemia o la neuropatía. Retrasan la cicatrización y conducen a la aparición de complicaciones.4
Las úlceras en el pie diabético se pueden prevenir con una adecuada estrategia que comprenda una correcta exploración y clasificación del riesgo y medidas efectivas de prevención que incluyan la educación y el autocuidado del pie.5
3.3.1. Detección y prevención del pie de riesgo
Un programa estructurado que contemple las siguientes fases nos permitirá estratificar el pie de riesgo y abordar de forma integral todas aquellas actividades preventivas que disminuirán la aparición de úlceras y lesiones en los pies.5
3.3.2. Identificar el pie de riesgo
La ausencia de síntomas en una persona con diabetes no excluye la enfermedad del pie. El cribado debe realizarse en todos los pacientes con diabetes mellitus tipo 2 en el momento del diagnóstico y, al menos, con una periodicidad anual.6
3.3.3. Exploración del pie de riesgo
Exploración vascular
 Antecedentes personales: úlcera previa/amputación de extremidad inferior. Presencia de malestar en las extremidades inferiores que aparece con el ejercicio y se calma con el reposo (claudicación intermitente). Dolor en reposo.
Antecedentes personales: úlcera previa/amputación de extremidad inferior. Presencia de malestar en las extremidades inferiores que aparece con el ejercicio y se calma con el reposo (claudicación intermitente). Dolor en reposo.
 Exploración de las EEII: inspección de los pies (eritema, palidez con la elevación de la extremidad, ausencia de pelo, uñas distróficas, sequedad de piel, fisuras, úlceras, etc.) y palpación de pulsos pedios y tibiales posteriores.7
Exploración de las EEII: inspección de los pies (eritema, palidez con la elevación de la extremidad, ausencia de pelo, uñas distróficas, sequedad de piel, fisuras, úlceras, etc.) y palpación de pulsos pedios y tibiales posteriores.7
 Sintomatología de claudicación intermitente, insuficiencia venosa, estado de la piel, etc.
Sintomatología de claudicación intermitente, insuficiencia venosa, estado de la piel, etc.
|
La American College of Cardiology Foundation (ACCF)8 considera: • ITB normal: 1,00 a 1,40. • ITB borderline: 0,91 a 0,99. • ITB sugestivo de AP: ≤ 0,90. • ITB sugestivo de calcificación arterial: ≥ 1,40. |
Según las últimas recomendaciones de la IWGDF (2020), el examen clínico no puede excluir de forma fiable la existencia o no de EAP, se deben de añadir pruebas objetivas como la detección de curvas doppler arteriales distales (arteria pedia y tibial posterior). Por lo tanto, el solo uso de itb en Atención Primaria queda relegado, siendo la primera opción la palpación de pulsos realizada de manera óptima.
No se debe utilizar el ITB en lugar de la palpación de pulsos como primera prueba de cribado en pacientes diabéticos con úlceras9.
Evaluación de la neuropatía diabética (NP)
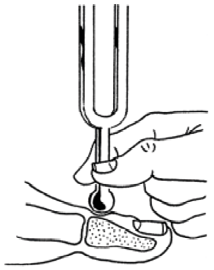
 Valoración de la sensibilidad superficial: tacto (usando un pincel o un algodón), dolor (mediante una aguja de punta roma o con el pinprick, que consiste en una pieza con una punta metálica no punzante) y temperatura (por medio de dos objetos que tengan diferentes temperaturas)10.
Valoración de la sensibilidad superficial: tacto (usando un pincel o un algodón), dolor (mediante una aguja de punta roma o con el pinprick, que consiste en una pieza con una punta metálica no punzante) y temperatura (por medio de dos objetos que tengan diferentes temperaturas)10.
 Valoración de la sensibilidad profunda:
Valoración de la sensibilidad profunda:
En caso de no disponer de ninguno de los dos instrumentos, se puede recurrir al test de Ipswich; test de sensación táctil que consiste en tocar ligeramente (1 o 2 segundos) las puntas del primer, segundo y quinto dedo de los dos pies con el dedo índice. Buena correlación con el monofilamento.11

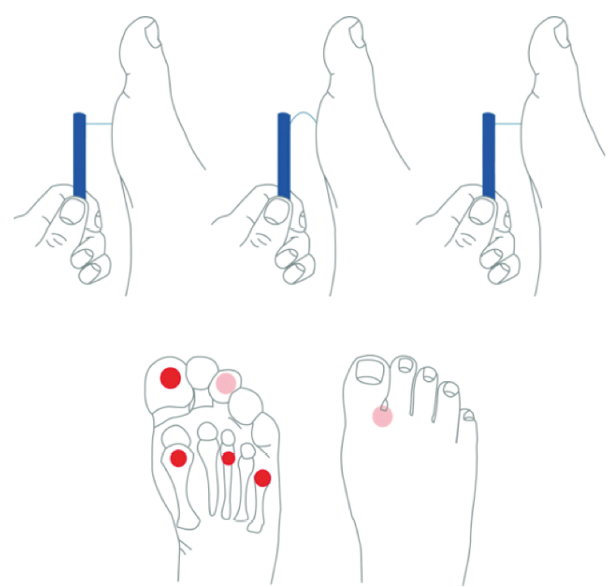



3.3.4. Clasificación del pie según el riesgo (según IWGDF)
Inspección y frecuencia de cribaje del pie de riesgo
(riesgo IWGDF 1 o superior)
Se recomienda la clasificación del paciente en cuatro categorías de riesgo en función de las exploraciones realizadas y de la sintomatología existente.

|
Categoría |
Riesgo de úlcera |
Características |
Frecuencia del cribaje |
|
0 |
Muy bajo |
Sin neuropatía ni arteriopatía periférica. |
Anual |
|
1 |
Bajo |
Neuropatía o arteriopatía periférica. |
Cada 6 o |
|
2 |
Moderado |
Neuropatía periférica con arteriopatía y/o deformidades. |
Cada 3 o |
|
3 |
Alto |
Neuropatía o arteriopatía más: • Historia de úlcera en el pie. • Amputación previa de extremidad. • Enfermedad renal en etapa terminal. |
Mensual o trimestral |
En una persona con diabetes que presente sintomatología de NP o enfermedad arterial periférica (IWGDF riesgo 1-3) se debe realizar un examen más exhaustivo que contemple las siguientes fases:
 Anamnesis: historial de amputaciones, úlceras en extremidad inferior, enfermedad renal en etapa terminal, comorbilidades, entorno social, educación sanitaria recibida...
Anamnesis: historial de amputaciones, úlceras en extremidad inferior, enfermedad renal en etapa terminal, comorbilidades, entorno social, educación sanitaria recibida...
 Estado vascular y exploración neurológica: claudicación, dolor, entumecimiento, palpación de pulsos, sensibilidad protectora...
Estado vascular y exploración neurológica: claudicación, dolor, entumecimiento, palpación de pulsos, sensibilidad protectora...
 Piel: evaluación del estado de la piel; hidratación, temperatura, presencia de hiperqueratosis, edema, signos preulcerativos...
Piel: evaluación del estado de la piel; hidratación, temperatura, presencia de hiperqueratosis, edema, signos preulcerativos...
 Hueso y articulaciones y valoración de la existencia de deformidades: dedos en garra, prominencias óseas anormalmente grandes, hallux valgus, movilidad articular limitada...
Hueso y articulaciones y valoración de la existencia de deformidades: dedos en garra, prominencias óseas anormalmente grandes, hallux valgus, movilidad articular limitada...
 Calzado: tipo de calzado, ajustes, amplitud, costuras, desgaste de la suela...
Calzado: tipo de calzado, ajustes, amplitud, costuras, desgaste de la suela...
 Higiene y cuidado de los pies: corte de uñas, hidratación, lesiones interdigitales, micosis, existencia de helomas, tipo de calcetín.
Higiene y cuidado de los pies: corte de uñas, hidratación, lesiones interdigitales, micosis, existencia de helomas, tipo de calcetín.
 Limitaciones físicas que pueden dificultar el autocuidado del pie: agudeza visual, obesidad, flexibilidad articular...
Limitaciones físicas que pueden dificultar el autocuidado del pie: agudeza visual, obesidad, flexibilidad articular...
 Autocuidado de los pies: grado de conocimiento.5
Autocuidado de los pies: grado de conocimiento.5
3.3.5. Educación sobre el cuidado del pie en consulta
La prevención es un pilar fundamental en esta patología y el paciente tiene un importante papel en el cuidado de los pies para evitar futuras lesiones. Las personas con diabetes y, en particular, aquellas con WGDF riesgo 1 o superior, deben aprender a realizar un correcto cuidado de sus pies para poder detectar cualquier signo de lesión.5
Siempre se debe recalcar al paciente que la higiene y la observación de los pies se considera una de las actividades preventivas más importantes que él puede realizar. El profesional ha de proporcionar los conocimientos necesarios de forma estructurada para garantizar suficientes habilidades de autocuidado y, en su defecto, dotar de los conocimientos necesarios a familiares y cuidadores habituales.
Asegurar el uso de calzado apropiado
El calzado deberá ajustarse a cualquier tipo de alteración biomecánica y de la estructura del pie. Las características del calzado variarán en función de la afectación y del grado de NP que la persona presente. Una de las causas más importantes de las úlceras en los pies es el uso de calzado inadecuado.
El calzado en personas con neuropatía y/o vasculopatía debe tener una función protectora frente al medio externo; protección térmica y mecánica, estabilización de la marcha, adaptación a la morfología del pie y capacidad para incorporar soportes plantares u órtesis.12 Según el riesgo recomendaremos:
 Sin NP o arteriopatía (IWGDF 0): calzado estándar bien adaptado a su pie.
Sin NP o arteriopatía (IWGDF 0): calzado estándar bien adaptado a su pie.
 Con NP y/o arteriopatía (IWGDF 1-3): recomendaremos un calzado con las siguientes características:
Con NP y/o arteriopatía (IWGDF 1-3): recomendaremos un calzado con las siguientes características:
En todo caso, se recomienda un calzado diseñado con materiales transpirables, flexibles y elásticos.
3.3.6. Tratamiento de los factores de riesgo de ulceración
En el paciente con diabetes debemos tratar todo signo preulcerativo que se presente en los pies: hiperqueratosis, helomas, uñas encarnadas y lesiones fúngicas; y recomendar revisiones podológicas anuales.
Asimismo, debemos poner especial atención a las deformidades existentes para poder aplicar las medidas preventivas necesarias; valoración de tratamiento ortopédico o quirúrgico (si fuera necesario).
3.3.7. Tratamiento de úlceras en el pie diabético9
Ante una persona con diabetes que presenta una úlcera de pie diabético, después de una adecuada valoración de exploración de la úlcera mediante valoración ósea (probe to bone test), realizaremos una valoración de la infección y descartaremos la presencia de isquemia mediante valoración de pulsos.
Una vez estratificada la lesión, se realizará desbridamiento quirúrgico y sistema de descarga básica, así como se deberá asegurar el calzado adecuado.
En cuanto a la utilización de apósitos, se debe considerar el uso de apósitos deoctosulfato de sacarosa, como primera opción terapéutica en úlceras neuroisquémicas o en aquellas que no responden al tratamiento estándar. Para la realización de dichas curas, se deben utilizar materiales que permitan el espaciado de estas entre 48-72 horas.
El pie debe ser aislado con un vendaje completo no compresivo.
Es muy importante señalar que si tras 15 días no se produce una evaluación positiva, debe ser derivado según el sistema establecido en cada comunidad autónoma. Las lesiones que presenten isquemia crítica o infección moderada/grave con o sin osteomielitis deben ser derivadas en un plazo no superior a 24 horas.

Bibliografía
Los contenidos publicados por la Fundación redGDPS son un servicio destinado a los profesionales sanitarios de atención primaria. Los contenidos requieren de una formación especializada para su correcta interpretación. En ningún caso la información proporcionada por Fundación redGDPS reemplazará la relación de los profesionales médicos con los pacientes.
La Fundación redGDPS no promueve ninguna actividad que pueda inducir a la prescripción de marcas comerciales, uso de sistemas de determinación de glucosa o productos dietéticos.