Resumen
Definimos el riesgo residual como aquel riesgo para el desarrollo de episodios vasculares incidentes o la progresión del daño vascular establecido, que persiste en un paciente correctamente tratado, es decir, con los principales factores de riesgo cardiovascular en objetivos. La evidencia disponible la obtenemos principalmente a partir de estudios con estatinas para la dislipemia diabética, del tratamiento antihipertensivo intensivo y de la antiagregación, principalmente en prevención secundaria. Sin embargo, el riesgo residual es cada vez más evidente, sobre todo en pacientes con diabetes. Esto nos lleva a abordar, en la era de la medicina de precisión, otros factores no bien estudiados pero sin duda de gran importancia en el abordaje global del la enfermedad cardiovascular.
Palabras clave: riesgo residual, factores de riesgo cardiovascular, dislipemia diabética, dislipemia aterogénica.
Hermans y Fruchart propusieron una definición holística de riesgo residual, entendido como: «el riesgo residual para el desarrollo de episodios vasculares incidentes o bien, la progresión del daño vascular establecido, que persiste en un paciente correctamente tratado basado en la mejor evidencia científica disponible»1. La presencia de diabetes (DM), tanto de tipo 1 (DM1) como de tipo 2 (DM2), incrementa el riesgo de aparición de la enfermedad cardiovascular (ECV) aterosclerótica. Este riesgo se triplica para la enfermedad arterial periférica y se dobla para la enfermedad coronaria y cerebrovascular. El riesgo residual incluye el riesgo establecido a partir de factores de riesgo cardiovascular (FRCV) clásicos, como dislipidemia, hipertensión arterial (HTA), DM2, inflamación o el estilo de vida, así como el relacionado con factores de riesgo cardiovascular emergentes1. Este concepto deriva de estudios de intervención, principalmente con estatinas. Entendemos la epidemiología clínica como: «la ciencia para hacer predicciones sobre individuos, utilizando métodos científicos sólidos, para obtener el tipo de información que nos permita tomar las decisiones adecuadas para el cuidado de nuestros pacientes»2. Sin embargo, no debemos olvidar la capacidad que tienen los estudios observacionales (real world data) para proporcionar información valiosa sobre la naturaleza y el efecto de los tratamientos de enfermedades que representan actualmente graves amenazas para la salud pública, como las enfermedades cardiovasculares. Debemos integrar los resultados de ambos para conseguir un correcto manejo de los pacientes. La epidemiología observacional ha demostrado que los pacientes hipertensos tienen un mayor riesgo de desarrollar complicaciones cardiovasculares3. Además, la disminución de las cifras de presión arterial se asocia con una reducción de los eventos CV, como la cardiopatía isquémica, el accidente cerebrovascular, la insuficiencia cardiaca y la mortalidad cardiovascular. Sin embargo, su correcto tratamiento no logra disminuir por completo el riesgo cardiovascular, por lo que no podríamos considerarlo completamente efectivo si solo logra prevenir una parte de los eventos CV atribuibles a la HTA. ¿Cuál es su riesgo residual una vez hemos controlado el resto de los factores de riesgo, aún con niveles óptimos de presión arterial? 4 La cuestión que nos deberíamos plantear es si esto mismo ocurre en pacientes con diabetes y, sobre todo, cuál es la repercusión que tiene en el desarrollo de complicaciones CV.
El riesgo residual es un ítem importante tanto en salud pública, para implementar nuevas medidas, como a nivel epidemiológico, para construir modelos de predicción más realistas. Es un concepto dinámico, en estrecha relación con las actualizaciones en las guías de práctica clínica basadas en la mejor evidencia científica disponible y que definen los estándares de atención. La confirmación de un importante riesgo residual en el paciente con DM2 abre la discusión sobre la importancia de un tratamiento más temprano, más intensivo y la necesidad de desarrollo de nuevos fármacos con los que alcanzar este objetivo5.
En conclusión, el estudio del riesgo residual debe estar mejor planteado en los estudios epidemiológicos. Es necesario perfeccionar los métodos para su evaluación, reconsiderar las medidas de exposición a los FRCV modificables así como los indicadores de tratamiento, tanto farmacológicos como de estilo de vida, a lo largo del tiempo.
El riesgo residual en el paciente
con diabetes
La ECV continúa siendo la principal causa de morbimortalidad en pacientes con DM2. Sin embargo, a pesar de la estabilización observada en décadas pasadas debido, fundamentalmente, al avance en los tratamientos farmacológicos, en la actualidad asistimos a un aumento en la incidencia de cardiopatía isquémica, enfermedad arterial periférica o ictus en adultos de mediana edad con diabetes6. Ello nos lleva a pensar que quizá el enfoque glucocentrista, centrado en un estricto control de las cifras de glucemia, no sea el más adecuado, y que nos estamos dejando por el camino otros actores secundarios que, cada día con más insistencia, reclaman su papel protagonista7. La prevención secundaria de la ECV ha estado tradicionalmente centrada en reducir el riesgo de un evento cardiovascular de origen aterosclerótico. Sin embargo, los pacientes con diabetes tienen un riesgo global aumentado para la ECV, por lo que está ampliamente justificado un enfoque de protección multiorgánica. Según datos del PSC (Prospective Studies Collaboration and Asia Pacific Cohort Studies Collaboration), la diabetes aumentaba la mortalidad CV también en pacientes con ECV establecida (OR 1,85; 95 % CI: 1,69-2,03)8. En el registro nacional sueco (NDR), los pacientes con DM2 presentan un aumento en la mortalidad CV (OR 1,14; 95 % CI: 1,13-1,15) que era el triple en menores de 55 años y prácticamente se igualaba en los mayores de 75 años, lo que evidencia la necesidad de la intensificación del esfuerzo terapéutico en los más jóvenes9.
Estratificación del riesgo cardiovascular en el paciente con diabetes
Se hace mandatorio abandonar el concepto de prevención primaria y secundaria cuando nos referimos a la ECV de la persona con diabetes. Debemos considerar la diabetes como un equivalente de riesgo y, por lo tanto, al paciente como de alto riesgo por la razón misma de la presencia de diabetes. La intensidad de tratamiento inicial deberá adecuarse al riesgo inicial, definido como la probabilidad de aparición de ECV aterosclerótica en un determinado periodo de tiempo, normalmente 10 años. Para la medición del ritmo de aparición de ECV, se utiliza la tasa de incidencia expresada como número de eventos por cada 1.000 pacientes/año. Por ello las guías, entre ellas la de la ESC en 20195 aconsejan estratificar a los pacientes según su riesgo cardiovascular, que nos permita un abordaje integral y, sobre todo, adaptado a dicho riesgo (Tabla 1).
Factores de riesgo cardiovascular ¿clásicos?
En el estudio Framingham, la mortalidad CV era tres veces mayor en los pacientes con DM y esta se asociaba con un elevado riesgo de insuficiencia cardiaca y cardiopatía hipertensiva. Los FRCV descritos fueron la HTA, los niveles bajos de c-HDL y elevados de c-LDL y la obesidad10. En el INTERHEART Study11, el OR para el desarrollo de IAM de ser fumador, la HTA y la DM era de 13,01 (99 % CI: 10,69-15,83); de 42,3 (99 % CI: 33,2-54,0) para el ratio ApoB/ApoA1, y de 80,2 % (99 % CI: 77,5-82,7) para la obesidad abdominal. Sin embargo, fue de 0,60 (99 % CI: 0,51-0,71) para consumo diario de frutas y verduras. Si hablamos de los nueve factores independientes (hábito tabáquico, historia de HTA o DM, obesidad abdominal, estilo de vida, consumo irregular de fruta y verdura, ingesta de alcohol, no realizar ejercicio físico y elevación de los lípidos plasmáticos, el OR era 129,20 (99 % CI: 90,24-184,99). En el registro nacional sueco (NRD), los pacientes con los cinco FCRV en rango (presión arterial sistólica, niveles elevados de c-HDL, habito tabáquico, HbA1c y baja actividad física), presentaban un riesgo al menos marginal de muerte por ECV, persistiendo el exceso de riesgo de hospitalización por IC. Y, sin embargo, se mantenía una relación constante entre la edad temprana, el número de FRCV fuera de objetivo y la probabilidad de muerte por ECV9.
Los estudios planteados para investigar el efecto de una intervención multifactorial en pacientes con DM2 son escasos; más bien se plantean para cuantificar la incidencia acumulada de ECV en pacientes con varios FRCV, entre ellos la albuminuria, que reciben tratamiento intensivo frente a los que reciben tratamiento convencional12,13. El inicio y la progresión de la albuminuria en la enfermedad renal del diabético es un marcador temprano de aparición de ECV. Un descenso de albuminuria del 20-30 %, especialmente de forma precoz, se asocia con una disminución de la progresión, tanto en la enfermedad renal del diabético como en la aparición y progresión de ECV14. La modificación del estilo de vida, el abandono del hábito tabáquico, la terapia antihipertensiva, el antiagregante plaquetario y el uso de estatinas han sido la base del tratamiento15. Sin embargo, en la era de la medicina de precisión, se hace necesario el enfoque individualizado, multiómico, dirigido al control de los mecanismos biológicos, fisiopatológicos y su interacción con el medio ambiente, que nos permitan prevenir futuros eventos CV16,17 (Figura 1).
Nos centraremos en las lipropoteínas, la trombosis, la inflamación y la obesidad. Las vías cardiometabólicas se abordarán posteriormente.
Dislipemia diabética o dislipemia aterogénica (DA)
Definida por la combinación de hipertrigliceridemia en ayunas (≥ 200 mg/dl), descenso de c-HDL (≤ 40 mg/dl y ≤ 50 mg/dl (hombres/mujeres), predominio de partículas de c-LDL pequeñas y densas y aumento de colesterol asociado a lipoproteínas ricas en triglicéridos (c-LRT), este fenotipo lipídico contribuye al riesgo residual en pacientes en los que se ha logrado el objetivo de c-LDL, ya que las partículas de c-LRT y sus remanentes pueden ser incluso más aterogénicas que las de LDL18. Su prevalencia, especialmente en personas con DM2, síndrome metabólico, enfermedad renal crónica, hiperlipemia familiar combinada, obesidad o mujeres con síndrome del ovario poliquístico es muy elevada. El principal obstáculo para tratar el riesgo residual debido a la dislipemia aterogénica, es la pérdida de conciencia sobre su incidencia y el impacto que puede tener en el riesgo cardiovascular. El uso de estatinas no elimina el riesgo residual debido a otras alteraciones lipídicas, como es el caso de la hipertrigliceridemia y/o los niveles bajos c-HDL. Un subanálisis del estudio PREDIMED mostró, en población con sobrepeso/obesidad, que la concentración de triglicéridos (Tg) (OR 1,04; 95 % CI: 1,02-1,06), c-HDL (OR 1,05; 95 % CI: 1,01-1,1) y c-LRT (OR 1,21; 95 % CI: 1,10-1,33), pero no de c-LDL, estaba asociada con la aparición del MACE19. El estudio IMPROVE-IT mostró el efecto beneficioso de la disminución adicional de las c-LDL, combinando una estatina con ezetimiba20. En los estudios FOURIER (Further Cardiovascular Outcomes Research with PCSK9 Inhibition in Subjects with Elevated Risk) y ODYSSEY Outcomes (Evaluation of Cardiovascular Outcomes After an Acute Coronary Syndrome During Treatment with Alirocumab), los pacientes con/sin DM2 con ECV alcanzaron importantes descensos de c-LDL y reducción de los eventos CV21,22. La reducción de niveles de Tg con omega 3 en pacientes con ECV y un FRCV en tratamiento con estatinas redujo de forma significativa los eventos CV23.
Trombosis
Es conocido el aumento en la agregabilidad plaquetaria en los pacientes con diabetes que predispone al aumento de los eventos trombóticos. Actualmente no está indicado el uso de antiagregantes plaquetarios (AAS) en pacientes sin ECV24. Sin embargo, se recomienda la prevención dual con AAS y otro agente antiplaquetario, inicialmente 12 meses inmediatamente tras un evento CV. Diferente es su uso de forma mantenida en ECV estable, por el alto riesgo de sangrado, como se puso en evidencia con Ticagrelor en el estudio THEMIS (Effect of Ticagrelor on Health Outcomes in Diabetes Mellitus Patients Intervention Study)25. En el estudio COMPASS (Cardiovascular Outcomes for People Using Anticoagulation Strategies), los pacientes de la rama AAS más Rivaroxabán 2,5 mg tuvieron menos eventos CV sin diferencias significativas en el riesgo de sangrado mayor o intracraneal que la rama AAS26. Las guías recomiendan la terapia antiplaquetaria en pacientes con alto/muy alto RCV5 (Tabla 2).
Inflamación
La diabetes, al igual que la obesidad, está asociada a un estado de inflamación sistémica leve-moderado, que predispone a la aparición de eventos CV ateroscleróticos y no ateroscleróticos. La proteína C-reactiva (PCR) es un importante predictor de aparición de ECV aterosclerótica e insuficiencia cardiaca27. Su disminución con estatinas ha demostrado ser beneficiosa en la reducción de ECV28. Otra familia implicada en la patogénesis de la enfermedad aterosclerótica son las interleukinas, especialmente la IL-1 e IL-6. En el estudio CANTOS (Canakinumab Antiinflammatory Thrombosis Outcome Study)29, la inhibición de la IL-1b disminuyó el riesgo de ictus, infarto o muerte CV en una población de alto riesgo residual inflamatorio, especialmente en aquellos que conseguían disminuir los niveles de PCR < 2 mg/l. La colchicina reduce el riesgo de eventos isquémicos frente a placebo en pacientes con IAM reciente, especialmente en pacientes con DM30.
Obesidad
La obesidad se relaciona con un estado de inflamación leve que predispone, junto a la disfunción del sistema inmune y del sistema nervioso simpático, a la aparición de la aterosclerosis y, por ende, a la ECV31. El adipocito obeso, a diferencia del delgado, tiene una sobreexpresión de citoquinas proinflamatorias, entre las que destacan la resistina, la leptina o la IL-6. Las tres están implicadas en la inflamación endotelial; el aumento en los niveles circulantes de resistina e IL-6 se asocian con la aparición de cardiopatía isquémica e infarto agudo de miocardio. La hiperleptinemia se asocia con marcadores de aterosclerosis subclínica32. Este concepto es muy interesante cuando nos referimos al riesgo residual de la persona con diabetes y obesidad, en íntima relación con el denominado fenotipo «obeso metabólicamente sano» (definido como aquella persona con obesidad con menos de dos criterios de síndrome metabólico de la ATP III excluyendo la circunferencia abdominal)33. El paso de un fenotipo metabólicamente sano a uno enfermo, en una persona delgada, aumenta casi por tres el riesgo de aparición de aterosclerosis subclínica, pero ese riesgo vuelve a su nivel basal una vez que se recupera el estado «metabólicamente sano»; en una persona con obesidad, el riesgo persiste elevado a pesar de volver al mal llamado estado «metabólicamente sano», sin duda, en íntima relación con el estado proinflamatorio34.
A modo de resumen, en la Tabla 2 se exponen los objetivos de control de FRCV en pacientes con diabetes.
El riesgo residual en la medicina
de precisión
En la Figura 2, se exponen de forma resumida los actuales objetivos de riesgo residual y las herramientas de los que disponemos actualmente para su control así como hacia dónde debemos dirigir nuestros esfuerzos.
Bibliografía
Introducción
Tabla 1. Estratificación del riesgo cardiovascular en pacientes con diabetes según ESC.
|
Riesgo muy alto |
DM y ECV establecida o Lesión de órgano dianaa (LOD) o 3 factores de riesgo cardiovascular b (FRCV) DM1 de más de 20 años de evolución |
|
|
Riesgo alto |
Pacientes DM de más de 10 años de evolución sin LOD con cualquier otro FRCV |
|
|
Riesgo moderado |
Paciente joven (DM1 < 35 años, DM2 < 50 años) con DM de menos 10 años de duración sin FRCV |
Adaptado de5: Cosentino F. 2019 ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD. Eur Heart J. 2020.
DM: diabetes mellitus; ECV: enfermedad cardiovascular; aLOD: proteinuria, filtrado glomerular > 30 ml/min/1,73 m2; hipertrofia ventricular izquierda, retinopatía; bFRCV: edad, hipertensión, dislipemia, fumador, obesidad.
Figura 1. Relación multidimensional en la patogénesis
de las enfermedades metabólicas.

Tabla 2. Resumen de los objetivos de control FRCV en pacientes con diabetes.
|
Factor de riesgo |
Objetivo |
|
Presión arterial |
PAS objetivo > 65 años 130 mmHg; < 130 mmHg si tolerado; nunca < 120 mmHg > 65 años: 130-139 mm Hg (individualizar) |
|
HbA1c |
< 7 % para la mayor parte de adultos < 6,5 %, personalizado evitando hipoglucemias/efectos adversos < 8 % en ancianos |
|
LDL-col |
< 55 mg/dl en DM con muy alto RCV < 70 mg/dl en DM con alto RCV < 100 mg/dl en DM con moderado RCV |
|
Antiagregación |
DM con alto/muy alto RCV |
|
Tabaco |
Abandono obligatorio |
|
Actividad física |
< 150 min/semana de ejercicio vigoroso, combinando aeróbico y resistencia |
|
Peso |
Estabilización del peso corporal en personas con sobrepeso/obesidad |
|
Hábitos dietéticos |
Reducción de la ingesta calórica No existen recomendaciones sobre el reparto de principios activos, se recomienda la dieta mediterránea |
Adaptado de5: Cosentino F. 2019 ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD. Eur Heart J. 2020.
HbA1c: hemoglobina glicosilada; LDL col: colesterol LDL; PAS: presión arterial sistólica; RCV: riesgo cardiovascular.
Figura 2. Propuesta de marco conceptual para abordar el riesgo de enfermedad cardiovascular aterosclerótica residual en la era de la medicina de precisión.
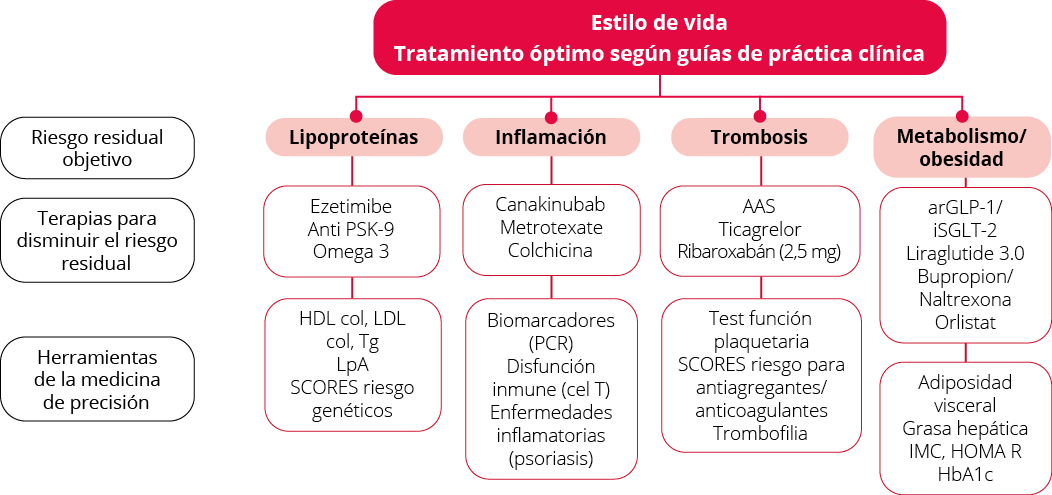
Adaptada de17 Patel KV. Conceptual framework for addressing residual atherosclerotic cardiovascular disease risk in the era of precision medicine. Circulation 2018.
AAS: ácido acetilsalicílico; arGLP-1: análogos del receptor del GLP-1; IMC: índice de masa corporal; iSGLT-2: inhibidores del cotransportador de sodio/glucosa; HbA1c: hemogloglina glicosilada; HOMA R: índice de resistencia a la insulina; LpA: lipoproteína A; PCR: proteína C reactiva; Tg: triglicéridos.