METODOLOGIA DE LA GUIA DE PRACTICA CLINICA
- Justificación, alcance y objetivos de una Guía de práctica clínica (GPC)
- Formulación de las preguntas clínicas de la GPC
- Búsqueda y selección de la evidencia científica
- Evaluación y síntesis de la evidencia científica
- Formulación de las recomendaciones
1.Justificación, alcance y objetivos de una Guía de práctica clínica (GPC)
Las guías de práctica clínica (GPC) son un “conjunto de recomendaciones basadas en una revisión sistemática de la evidencia y en la evaluación de los riesgos y beneficios de las diferentes alternativas, con el objetivo de optimizar la atención sanitaria a los pacientes”(1). Además, las GPC tienen la potencialidad de reducir la variabilidad y mejorar la práctica clínica.
En los anteriores proyectos de la GPC de la red GDPS en diabetes mellitus tipo 2 (DM2) (2-3) nos hemos basado siguiendo una metodología común, recogida en el Manual Metodológico de Elaboración de GPC en el SNS publicado en el año 2007 (4). El nuevo manual del 2016 (5) actualiza para la evaluación de la calidad y la graduación de la fuerza de las recomendaciones el sistema Grading of Recommendations Assessment, Development and Evaluation (GRADE) (6) frente al sistema SIGN (propuesto por Scottish Intercollegiate Guidelines Network) (7) que nosotros seguimos empleando. El sistema GRADE tiene varias ventajas al formular las recomendaciones de las GPC no sólo en base a la efectividad de las intervenciones, sino teniendo en cuenta también el impacto que pueden tener sobre el uso de recursos y los costes, la opinión de los pacientes y una valoración de los riesgos y beneficios de la intervención, pero resulta un sistema complejo para profesionales no familiarizados con un análisis riguroso de la metodología del mismo. El instrumento AGREE II ofrece un marco para evaluar la calidad de una GPC y proporciona orientaciones para su adecuado desarrollo(8).
La delimitación del alcance y los objetivos de una GPC es una etapa crucial en su elaboración y es necesario integrar en la propuesta inicial de los promotores sugerencias provenientes de profesionales expertos y de los miembros del grupo elaborador de la guía . El resultado final será un documento claro, preciso y estructurado que incluya los siguientes aspectos: Justificación, Objetivos generales y específicos, Descripción detallada de los pacientes objeto de estudio, Aspectos clínicos que van a ser tratados, Ámbito o contexto de aplicación, Aspectos excluidos y Usuarios finales.
2. Formulación de las preguntas clínicas de la GPC
Una vez determinado el alcance y objetivos se elabora una lista de preguntas clínicas que se van a responder, deben formularse con un formato PICO, de manera que definan los límites de la revisión de la evidencia, constituyan el esquema para el desarrollo de las búsquedas de literatura y actúen como guía para la formulación de recomendaciones.
La elaboración de la GPC se realizó con el formato PICO que propone especificar e identificar cuatro componentes clave bien diferenciados: La población a la que va dirigida (Pacientes), especificando grupos de edad, sexo, estadio de la enfermedad, comorbilidad, nivel de riesgo, contexto, La intervención que se va a evaluar (Intervención), que incluye dispositivo, procedimiento, prueba diagnóstica, exposición, factor pronóstico, factor de riesgo, agente etiológico, etc. La intervención con la que se quiere comparar (Comparador). Las variables de resultado o desenlaces de interés (Outcomes), considerando los clínicamente relevantes e importantes para el paciente.
3. Búsqueda y selección de la evidencia científica
La evidencia científica que se requiere para elaborar una guía de práctica clínica puede, por lo general, proceder de tres tipos de fuentes de información: Guías de práctica clínica, Revisiones sistemáticas (RS) y otras síntesis de la evidencia científica. Los estudios los podemos clasificar según la Pirámide 6S (Figura 1) (9).
En esta nueva GPC hemos utilizado como base las anteriores GPC (2-3) y teniendo como referencias las GPC de la NICE, CMAJ y ADA. En el ámbito de otras síntesis de evidencia científica “Up to date” y TRIP database y en RS la Cochrane Library. En el caso de controversias en los estudios de las distintas fuentes o literatura menos reciente a dos años, hemos realizado búsquedas en bases primarias como PubMed/MEDLINE.
Tambien hemos utilizado sistemas de alerta bibliográfica como Evidence Updates de la Universidad de McMaster (Canadá) y las opiniones de expertos.
Existen muchas fuentes de información y estrategias de búsqueda, que dado lo prolijo y costoso de realizar y el tiempo a emplear son temas a plantearse en las actualizaciones de las GPC(10-11).
4.Evaluación y síntesis de la evidencia científica
En nuestra guía hemos realizado una evaluación y síntesis basada en los siguientes apartados por cada pregunta:
4.1.Volumen de la evidencia: Donde se plasma el número de ensayos clínicos aleatorizados( ECA), Revisiones sistemáticas (RS) o metaanálisis, estudios de cohortes, observacionales..
4.2. Aplicabilidad: Comentar hasta qué punto las pruebas encontradas son aplicables a nuestra sistema de salud Comentar cómo es de razonable generalizar los resultados de los estudios utilizados como evidencia a la población diana de esta GPC.
4.3. Consistencia: se valorará la consistencia entre las distintas GPS, ECAs o RS y las divergencias o acuerdos que puedan haber entre las mismas.
4.4.Relevancia/ Impacto clínico: Comentar el impacto clínico que la intervención objeto de estudio podría tener: tamaño de la población; magnitud del efecto; beneficio relativo frente a otras opciones; implicaciones en recursos; balance entre riesgo y beneficio.
4.5. Grado/ clasificación de la evidencia: Resume la síntesis de toda la evidencia realizada por el grupo de trabajo en relación a la pregunta clave, teniendo en cuenta todos los puntos anteriores, indicando el nivel de evidencia asignado según la tabla de evidencia del SIGN (tabla 2)(7)
5. Formulación de las recomendaciones
La fuerza de las recomendaciones refleja el grado de certeza de que los efectos deseables de una intervención recomendada superan sus efectos no deseables, o viceversa, en la población de interés. Para ello utilizamos la tabla de recomendaciones del SIGN derivado del grado de calidad de la evidencia.
Hemos procurado en la GPC introducir una justificación que defienda esa recomendación o la aclare en algunos términos apoyándonos en costes/ beneficios de la intervención o impactos o posibles opiniones de los pacientes y sobre todo en los posibles riesgos o beneficios de la intervención que no estén los suficientemente aclarados. En las recomendaciones con mayor certeza se utilizan los términos “ Se recomienda” ( Grado A) mientras en las de Grado B se utilizan los términos “ se sugiere”, siendo estos términos redactados en sentido negativos cuando la evidencia de la intervención es negativa “ no se recomienda” o “ no se sugiere”.(7)
Bibliografía
- Institute of Medicine (U.S.). Committee on Standards for Developing Trustworthy Clinical Practice Guidelines. Clinical practice guidelines we can trust [Internet]. Graham R, et al., editores. Washington, D.C.: The National Academies Press; 011 [consultado 15/12/2018]. Disponible en: http://www.nap.edu/read/13058/chapter/1
- Ezkurra P, Artola S, Diez J, Franch J, García J,Mata M et al. Práctica Clínica en la DM2. Análisis crítico por la red GDPS.; 2011:1-124. [Consultado 18/12/2018] Disponible en: http://www.redgdps.org/index.php?idregistro=542
- Ezkurra Loiola P, coordinador. Fundación redGDPS. Guía de actualización en diabetes mellitus tipo 2. Badalona: Euromedice Vivactis; 2017. [Consultado 18/12/2018] Disponible en: http://www.redgdps.org/guia-de-actualizacion-en-diabetes-20161
- Grupo de trabajo sobre GPC. Elaboración de Guías de Práctica Clínica en el Sistema Nacional de Salud. Manual Metodológico [Internet]. Madrid: Plan Nacional para el SNS del MSC. Instituto Aragonés de Ciencias de la Salud-IACS; 2007. (Guías de Práctica Clínica en el SNS: IACS Nº 2006/0I) [consultado 18/12/2018]. Disponible en: http://portal.guiasalud.es/emanuales/elaboracion/index-02.html
- Grupo de trabajo para la actualización del Manual de Elaboración de GPC. Elaboración de Guías de Práctica Clínica en el Sistema Nacional de Salud. Actualización del Manual Metodológico [Internet]. Madrid: Ministerio de Sanidad, Servicios Sociales e Igualdad; Zaragoza: Instituto Aragonés de Ciencias de la Salud (IACS); 2016 [Febrero 2018]. [consultado 18/12/2018] Disponible en: http://portal.guiasalud.es/emanuales/elaboracion_2/
- GRADE working group. Grading of Recommendations of Assessment Development and Evaluations [Internet] [consultado 15/12/2018]. Disponible en: http://www.gradeworkinggroup.org/ .
- Scottish Intercollegiate Guidelines Network (SIGN). SIGN 50: a guideline developer’s handbook [Internet]. Edinburgh: SIGN; 2014 [consultado 18/06/2015]. Disponible en: http://www.sign.ac.uk/guidelines/fulltext/50/ .
- Instrumento AGREE II. Instrumento para la evaluación de Guías de Práctica Clínica [Internet]. Traducción a cargo de GuíaSalud. TheAgreeResearch Trust; 2009 [consultado 18/12/2018]. Disponible en: http://www.guiasalud.es/contenidos/documentos/Guias_Practica_Clinica/Spanish-AGREE-II.pdf. (Obra original: Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, et al. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ [Internet]. 2010 Dec 14;182(18):E839-42 [consultado 10712/2018]. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3001530/ ).
- Murad MH, Asi N, Alsawas M, Alahdab F.New evidence pyramid.BMJ Evidence-Based Medicine 2016;21:125-127.
- Identifying the evidence: literature searching and evidence submission. En: National Institute for Health and Clinical Excellence (NICE). The guidelines manual [Internet]. London: NICE; 2012 [consultado 22/12/2018]. Disponible en: http://www.nice.org.uk/article/pmg6/chapter/5-identifying-the-evidence-literature-searching-and-evidence-submission
- Wilczynski NL, McKibbon KA, Walter SD, Garg AX, Haynes RB. MEDLINE clinical queries are robust when searching in recent publishing years. J Am Med Inform Assoc [Internet]. 2013 Mar-Apr;20(2):363-8 [consultado 09/12/2018]. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3638187/ .
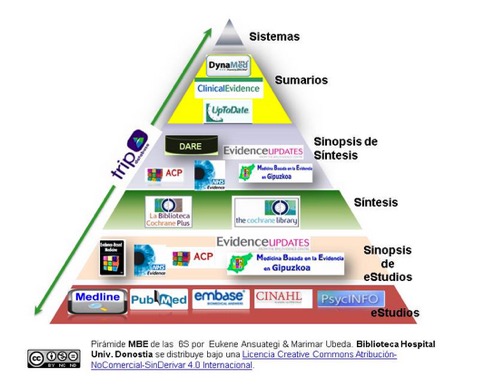
Tabla Niveles de evidencia y grados de recomendación de SIGN 1
| Niveles de evidencia | |
|---|---|
| 1++ | Metaanálisis de alta calidad, revisiones sistemáticas de ensayos clínicos o ensayos clínicos de alta calidad con muy poco riesgo de sesgo |
| 1+ | Metaanálisis bien realizados, revisiones sistemáticas de ensayos clínicos o ensayos clínicos bien realizados con poco riesgo de sesgos |
| 1– | Metaanálisis, revisiones sistemáticas de ensayos clínicos o ensayos clínicos con alto riesgo de sesgos |
| 2++ | Revisiones sistemáticas de alta calidad de estudios de cohorte o de casos y controles. Estudios de cohorte o de casos y controles con riesgo muy bajo de sesgo y con alta probabilidad de establecer una relación causal |
| 2+ | Estudios de cohorte o de casos y controles bien realizados con bajo riesgo de sesgo y con una moderada probabilidad de establecer una relación causal |
| 2– | Estudios de cohorte o de casos y controles con alto riesgo de sesgo y riesgo significativo de que la relación no sea causal |
| 3 | Estudios no analíticos, como informes de casos, series de casos o estudios descriptivos |
| 4 | Opinión de expertos |
| Grados de recomendación | |
| A | Al menos un metaanálisis, revisión sistemática o ensayo clínico clasificado como 1++ y directamente aplicable a la población diana de la guía; o un volumen de evidencia compuesto por estudios clasificados como 1+ y con gran consistencia entre ellos |
| B | Un volumen de evidencia compuesto por estudios clasificados como 2++, directamente aplicable a la población diana de la guía y que demuestran gran consistencia entre ellos; o evidencia extrapolada desde estudios clasificados como 1++ o 1+ |
| C | Un volumen de evidencia compuesto por estudios clasificados como 2+ directamente aplicables a la población diana de la guía que demuestran gran consistencia entre ellos; o evidencia extrapolada desde estudios clasificados como 2++ |
| D | Evidencia de nivel 3 o 4; o evidencia extrapolada desde estudios clasificados como 2+ |
| Buena práctica clínica | |
| ✓ | Práctica recomendada basada en la experiencia clínica y el consenso del equipo redactor |

